 |
Когда придворные медики подтвердили её опасения, поставив диагноз «гемофилия» маленькому Алеше, царская семья погрузилась в печаль. По свидетельству коменданта императорского дворца В. Н. Воейкова, Николай II, страстно любивший сына-наследника, за одну ночь постарел на десять лет, узнав, что малышу грозит преждевременная смерть или, в лучшем случае, жизнь инвалида.
8 октября были объявлены имена первых лауреатов Нобелевской премии этого года — в области физиологии и медицины. Согласно решению Шведской королевской академии наук, лауреатами стали Марио Капекки (Mario Capecchi), Оливер Смитис (Oliver Smithies) и сэр Мартин Эванс (Martin Evans).
Они удостоены награды за «изучение принципов введения специфических генетических модификаций в организмы мышей с использованием стволовых клеток». Разработанная методика позволяет создавать мышь с мутацией в любом выбранном изучаемом гене. «Фантастичность» методики заключается в том, что ученый сам может выбрать, какой ген видоизменить и как именно видоизменить.
Одним из способов видоизменения гена является его замена на бессмысленную последовательность ДНК — тогда ген «выключается». Исследователи систематически «выключают» гены и наблюдают, к каким последствиям на уровне организма приводит это «выключение». Такая методика называется «генетический нокаут» (gene knockout).
Она позволяет подробно изучить функцию конкретного гена во время эмбрионального развития и после рождения животного. Можно проследить, как каждый ген влияет на развитие организма и возникновение той или иной патологии. В связи с этим, метод ещё получил название «генетическое планирование». К настоящему моменту уже проведены опыты по «выключению» десяти тысяч генов мыши, это половина всего мышиного генома.
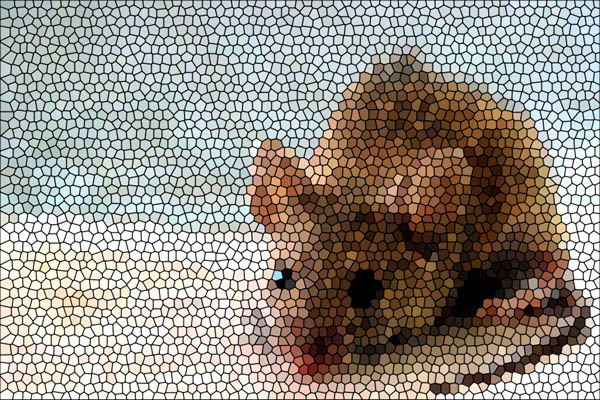 |
| «Мозаичная» мышь является носителем как нормального гена, так и исследуемого — целевого гена или же «нокаутного», если ген был дезактивирован. По фотографии (Creative Commons license) Jesus Solana. |
Концепция генной терапии предполагает, что наиболее действенный способ излечиться от заболевания, связанного с изменением генетического содержания клеток, — устранение генетической причины болезни, а не её следствий. Речь идет не только о лечении наследственных болезней — раковая клетка, например, возникает в результате мутации здоровой соматической клетки.
Различные вирусные инфекции также могут вносить изменения в наш геном, поскольку вирус вносит в наши клетки свой собственный генетический материал. Способ борьбы с этими генетическими изменениями заключается в искусственном введении в пострадавшую клетку новой генетической информации, призванной поправить ту, с которой связана болезнь.
Эта теория появилась после того, как были изучены механизмы внедрения вирусов в клетки. Некоторые вирусы очень стабильно внедряют свой генетический материал в геном клетки хозяина. А значит, вирусные частички можно использовать для доставки нужных генов в клетки.
Днем рождения генной терапии считают 14 сентября 1990 года — день, когда в клинике Национального института здоровья США (NIH) была проведена первая операция для лечения довольно редкого моногенного заболевания, то есть заболевания, связанного с дефектом в одном-единственном гене. Это заболевание, один из вариантов наследственного иммунодефицита, обусловлено мутацией в гене аденозиндезаминазы (adenosine deaminase gene, ADA).
Больной ребенок из-за плохой работы иммунитета подвергается атаке любых инфекций, с которыми он сталкивается. Четырёхлетняя девочка до операции не могла выходить на улицу, общаться с кем-либо, кроме членов семьи, и регулярно принимала огромное количество лекарств. Её родственники были вынуждены принимать чрезвычайные меры для соблюдения стерильности в доме.
 |
| ДНК упакована в хромосомы, которые представлены парами — одна хромосома наследуется от отца, другая — от матери. Обмен генетической информацией (последовательностями ДНК) между хромосомами в паре происходит за счёт гомологичной рекомбинации. Марио Капекки продемонстрировал, что дефективный ген может быть исправлен посредством гомологичной рекомбинации с искусственно введённой в клетку ДНК. Фото: Tim Kelly/University of Utah. |
Кажется, ничего сложного: взяли клетки, «вложили ген», запустили клетки обратно, и все заработало. На самом деле это дело трудоемкое и кропотливое.
Есть несколько условий, которые необходимо выполнить для успешной терапии: ген надо доставить до места назначения (в определенные клетки, а не просто впрыснуть куда-нибудь), он должен заработать в этих клетках и, что важно, работать правильно.
Вводить гены в клетки можно двумя способами. Либо брать клетки у пациента, трансформировать их и возвращать «на родину», как было сделано в случае с наследственным иммунодефицитом. Либо вводить вирусную частичку, содержащую нужный ген, прямо в организм. Во втором случае, например, создают конструкцию, содержащую, кроме нужного гена, некий рецепторный белок — это может быть антиген, специфичный для определенной ткани организма. Рецепторный белок выполняет функцию адреса, указанного на конверте с письмом-геном.
С контролем уровня и времени «работы» нового гена пока дело обстоит хуже, хотя больше тысячи лабораторий во всем мире занимаются решением этих вопросов.
Ещё одна большая проблема — безвредность терапии, ведь заповедь «не навреди» остается главной во врачебном деле. Существует резонный аргумент, что новый ген может изменить всю программу клетки и не вылечить её, а, к примеру, превратить в раковую.
 |
| Мартин Эванс работал с клетками мышиной эмбриональной карциномы (ЭК), которые он пытался использовать как транспортное средство для внесения генетического материала в мышиную зародышевую линию. Эванс потерпел неудачу, поскольку клетки ЭК имели необычный набор хромосом и не могли дать начало зародышевой линии. Но он обнаружил, что нормальную по числу хромосом культуру клеток можно получить из ранних мышиных эмбрионов. Теперь эти клетки называют эмбриональными стволовыми клетками. Вкладом Эванса было создание необходимого «транспортного средства» для доставки в зародышевую линию — эмбриональных стволовых клеток. Фото: Cardiff University. |
К сожалению, были в истории генной терапии и случаи неудачного вмешательства со смертельным исходом. Семнадцатилетнего Джесса Гелзингера (Jesse Gelsinger) пытались лечить путем генной терапии от наследственного заболевания печени — недостаточности орнитинтранскарбомилазы (OTCD). В печень Джесса вводили аденовирус, содержащий ген ОТСD. Естественно, прежде чем приступить к лечению пациентов, метод прошел все положенные испытания — и на грызунах, и на обезьянах. До Гелзингера подобную операцию перенесли семнадцать человек.
Но Гелзингер умер. Умер вследствие гиперреакции иммунной системы на ввод генноинженерного аденовируса. Позднее выяснилось, что обезьяны тоже умирали, однако ученые, проводившие операции, видимо, очень хотели продолжать работу и «забыли» предупредить о таком «незначительном» факте Управление по контролю за пищевыми продуктами и лекарственными препаратами США (US Food and Drug Administration), которое наверняка не допустило бы применения опасного метода для лечения людей.
Выяснилось также, что у пациентов, получивших ранее более низкую дозу аденовируса, наблюдалась сильная интоксикация печени. И об этом тоже умалчивалось. Справедливости ради надо отметить, что данный случай, скорее, относится к разряду исключений и связан, в большей степени, с недопустимым поведением исследователей, чем с опасностью самой терапии.
За последние два года ученые, проводящие эксперименты в области генной терапии, порадовали нас рядом новых достижений.
В журнал Science в 2006 году были опубликованы результаты работы ученых Национального института Здоровья США (NIH), которые под руководством Стивена Розенберга (Steven A. Rosenberg) начали успешно лечить метастатическую меланому - самое агрессивное опухолевое заболевание. При этом они не вводили в раковые клетки какой-нибудь ген-камикадзе, уничтожающий их и себя.
 |
| Смитис изначально пытался исправить мутировавшие гены в клетках человека, полагая, что некоторые болезни крови, передающиеся по наследству, можно вылечить, исправив вызывающие болезнь мутации в стволовых клетках красного кровяного мозга. Он открыл, что гены в клетке могут быть направленно изменены вне зависимости от их активности. Это наталкивало на мысль, что вообще любые гены доступны для гомологичной рекомбинации. Фото: Institute of Medicine/The University of North Carolina at Chapel Hill. |
1 мая 2007 года Институт офтальмологии Университетского колледжа Лондона (Institute of Ophthalmology, University College London) объявил о том, что на их базе в начале 2007 года была впервые в мире проведена генная терапия наследственной болезни сетчатки. Пациент успешно перенес операцию, но пока рано говорить о том, насколько успешным оказалось вмешательство.
Под руководством доктора Пауля Така (Paul P. Tak) из Амстердамского университета (Universiteit van Amsterdam) были проведены успешные эксперименты на животных, в которых геннотерапевтический подход использовали для лечения ревматоидного артрита.
Наиболее эффективные попытки лечить это заболевание направлены на блокирование белка TNF. В экспериментах, о которых идет речь, животным вводили ген, кодирующий ингибитор белка TNF, и наблюдали значительное уменьшение воспалительного процесса. Теперь ученые планируют использовать разработанный подход для лечения пациентов.
В этом году стало известно об успешном применении генной терапии для лечения болезни Паркинсона. Группа биологов и нейрохирургов из Нью-Йорка (New York-Presbyterian Hospital/Weill Cornell Medical Center) использовала непатогенный вирус, так называемый аденоассоциированный вирус, для доставки в нейроны гена, кодирующего фермент декарбоксилазу глутаминовой кислоты.
Ген «заставляет» нервные клетки производить гамма-аминобутировую кислоту (GABA), что приводит к восстановлению биохимического баланса в нейронах, и, как следствие, к нормализации моторной функции больных. Исследователи наблюдают 12 пациентов и отмечают улучшение моторной функции по разным показателям у 25–65% больных.
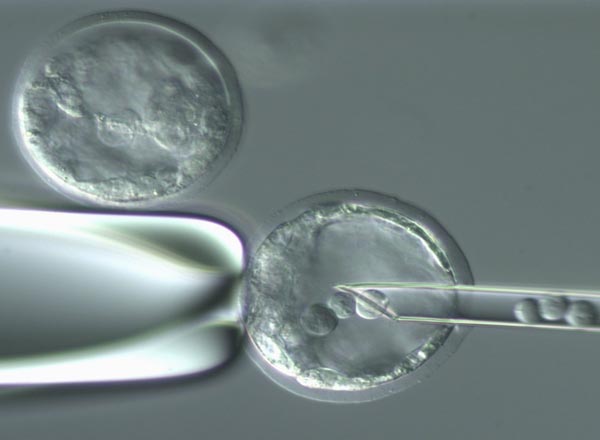 |
Вокруг проблем такого рода (как и вокруг банков стволовых клеток, и регенерационной медицины) ведутся жаркие дискуссии на тему этичности вмешательства. Ведь можно и в половые клетки вводить нужные гены, чтобы избавить все будущее потомство от наследственного недуга. В самой идее нет ничего крамольного. Но в истории уже был подобный прецедент — евгеника, которая легла в основу нацистской расовой политики.
Евгенические идеи были очень популярны не только среди политиков, но и среди ученых разных стран. 60 тысяч человек в США и 350 тысяч в Германии подверглись принудительной стерилизации «по евгеническим соображениям» — они были евреями, цветными, инвалидами, бедняками, сиротами… Одним словом, «неполноценными людьми».
Где гарантия, что, если в половые клетки начнут вводить гены для коррекции разных недостатков, люди, развившиеся из таких исправленных клеток (которые будут безупречно здоровыми) не соберутся в избранное общество и не решат, что остальные — «неполноценные»?
Общественность принимает во внимание такую возможность, однако генная терапия настолько перспективна, что «прикрыть» её невозможно, да и нет в этом необходимости. Большинство стран (без участия России) в 1997 году подписало «Конвенцию о правах человека и биомедицине», вступившую в действие в 1999-м.
Статья 11 этой конвенции запрещает любую форму дискриминации по признаку генетического наследия того или иного лица. Статья 13 гласит: вмешательство в геном человека, направленное на его модификацию, может быть осуществлено только в профилактических, терапевтических или диагностических целях и только при условии, что подобное вмешательство не направлено на изменение генома наследников данного человека.
Технические и этические затруднения несколько тормозят развитие практической генной терапии. Большинство исследований в этой области пока не доходят до клинического применения. Тем не менее, в очень короткий срок генная терапия перестала быть фантастической идеей и стала реальностью.
автор: Наталья Александрова
Хотите прокомментировать?
Кроме того...
Спички
Человеческое желание научиться добывать огонь, чтобы обогревать себя и...
Любовь и роботы. Влечение человека к машине стало реальностью
Социологи недавно стали...
Melissa Theuriau
Самая красивая телеведущая Франции и одна из самых красивых телеведущих мира...